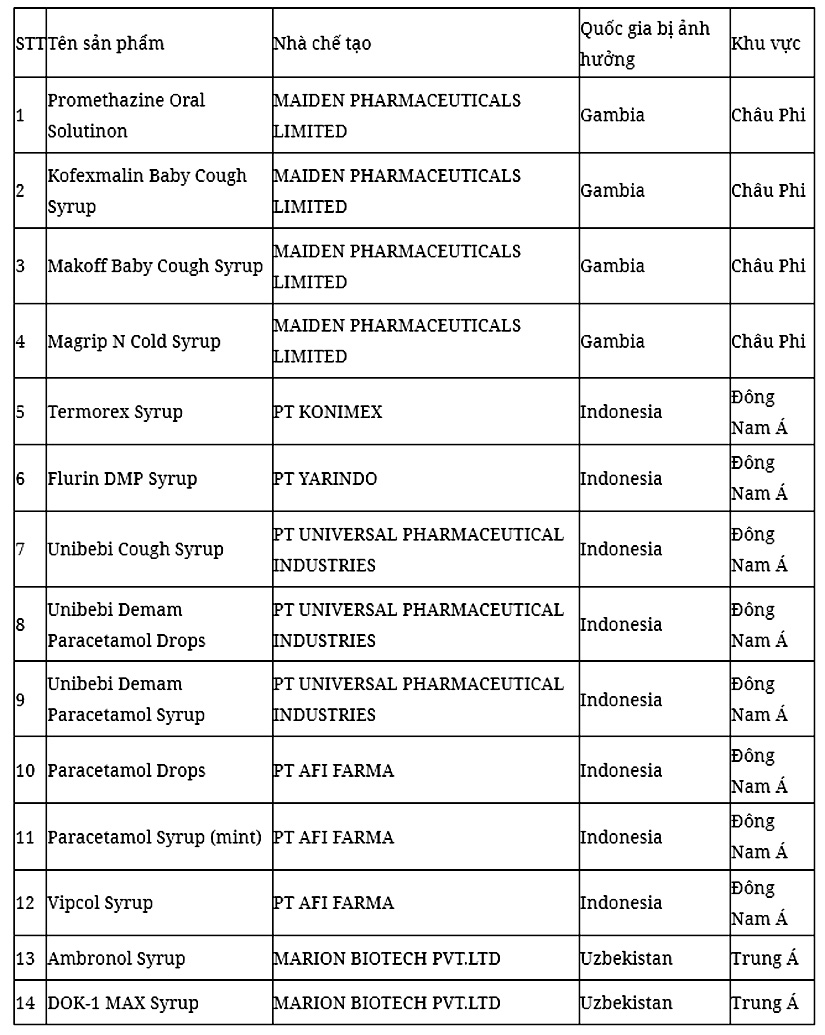
Cảnh báo 14 sản phẩm siro ho bị cấm sử dụng
Bộ Y tế vừa có văn bản số 2349/BYT-QLD gửi Sở Y tế các tỉnh, thành phố trực thuộc Trung ương; các cơ sở khám, chữa bệnh trực thuộc Bộ Y tế cảnh báo đối với một số sản phẩm siro ho bị cấm sử dụng.
Bộ Y tế cho biết đã nhận được Công điện của Tổ chức Cảnh sát hình sự quốc tế (Interpol) cảnh báo các cơ quan chức năng thành viên của Interpol về việc hàng trăm trẻ em đã tử vong hoặc bị tổn thương thận cấp tính sau khi sử dụng 14 sản phẩm siro bị cấm ở một số quốc gia.
Theo thông tin từ Interpol, các sản phẩm này được sản xuất tại Ấn Độ và Indonesia có chứa Diethylene có thể dẫn đến tổn thương sức khỏe nghiêm trọng hoặc tử vong cho người sử dụng.
Theo rà soát của Bộ Y tế (Cục Quản lý Dược), 14 sản phẩm này chưa được cấp giấy đăng ký lưu hành thuốc tại Việt Nam và cũng chưa được cấp giấy phép nhập khẩu vào Việt Nam.
Để bảo đảm an toàn cho người sử dụng, Bộ Y tế đề nghị Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, các cơ sở khám, chữa bệnh trực thuộc Bộ Y tế khẩn trương triển khai các hoạt động, cụ thể:
Phổ biến, thông báo cho các cơ sở y tế, cơ sở dược trên địa bàn, các khoa, phòng tại đơn vị biết về các thông tin cảnh báo đối với 14 sản phẩm siro ho nêu trên để khuyến cáo về tác hại nghiêm trọng nếu sử dụng sản phẩm và nghiêm cấm sử dụng.
Tăng cường tuyên truyền trên địa bàn và tại đơn vị về việc không sử dụng các thuốc không được cấp phép lưu hành, không rõ nguồn gốc, xuất xứ.
Sở Y tế các tỉnh, thành phố trực thuộc Trung ương tiến hành thanh tra, kiểm tra tại các cơ sở kinh doanh dược việc lưu hành các sản phẩm này nói riêng và các thuốc không có nguồn gốc, xuất xứ, chưa được cấp phép lưu hành nói chung trên thị trường.
Bộ Y tế lưu ý: Trường hợp phát hiện các sản phẩm này có lưu hành, tiến hành thu hồi, tiêu hủy và xử lý vi phạm đối với các cơ sở kinh doanh dược theo quy định, tránh gây hại cho người sử dụng.
Kết quả kiểm tra, xử lý các trường hợp vi phạm (nếu có), đề nghị Sở Y tế báo cáo về Bộ Y tế (Cục Quản lý Dược).
Trước đó, tháng 10/2022, Tổ chức Y tế Thế giới (WHO) đã thông báo hàng chục trẻ nhỏ ở Gambia, một quốc gia ở Tây Phi tử vong do tổn thương thận cấp tính có thể liên quan đến siro trị ho, cảm bị nhiễm độc do một nhà sản xuất thuốc của Ấn Độ sản xuất.
Theo Reuters, cảnh báo này bao gồm 4 sản phẩm: Promethazine Oral Solution, Kofexmalin Baby Cough Syrup, Makoff Baby Cough Syrup và Magrip N Cold Syrup.
Kết quả phân tích trong phòng thí nghiệm phát hiện lượng diethylene glycol và ethylene glycol ở mức "không thể chấp nhận được". Những chất này rất độc hại và có thể gây tử vong hoặc khiến người dùng gặp phải các tác dụng phụ như đau bụng, nôn mửa, tiêu chảy, đau đầu… có thể gây độc và dẫn đến tổn thương thận cấp tính.
WHO dẫn thông tin của Cơ quan Kiểm soát chất lượng dược phẩm Ấn Độ cho biết, Công ty Maiden Pharmaceuticals Ltd chỉ mới cung cấp những thuốc trên đến Gambia. Tuy nhiên, WHO không loại trừ khả năng những siro trên được cung cấp đến các nước khác theo đường không chính thức.
WHO kêu gọi các nước rà soát và cấm lưu hành những sản phẩm này để không gây tổn hại thêm cho các bệnh nhân.
Cục Quản lý Dược, Bộ Y tế cho biết đã nhận được thông tin và đã tiến hành rà soát danh mục các thuốc được nhập về Việt Nam.
Kết quả rà soát cho thấy Việt Nam chưa cấp số đăng ký nào cho Công ty Maiden Pharmaceuticals Ltd; chưa cấp số đăng ký cho 4 sản phẩm thuốc ho Promethazine Oral Solution, Kofexmalin Baby Cough Syrup, Makoff Baby Cough Syrup và Magrip N Cold Syrup. Đồng thời Công ty Maiden Pharmaceuticals Ltd cũng không có hồ sơ nào đang nộp tại Cục.
Cục Quản lý Dược cũng khuyến cáo người dân chỉ nên mua các sản phẩm thuốc có nguồn gốc xuất xứ rõ ràng, đã được cấp số đăng ký lưu hành, tránh mua, sử dụng các sản phẩm trôi nổi, các sản phẩm rao bán trên các trang mạng.
Tin khác
- Thực phẩm thiên nhiên giúp điều trị sẹo do thủy đậu
- Phòng bệnh tiêu chảy cho trẻ
- TP. Điện Biên Phủ tiếp nhận được 269 đơn vị máu
- Nỗ lực phòng chống HIV/AIDS
- Số mắc Covid-19 tăng lên 780 ca/ngày, Bộ Y tế khuyến cáo các biện pháp phòng dịch
- Vi rút SARS-CoV-2 vẫn tồn tại, tập trung bảo vệ nhóm nguy cơ cao
- Tuyệt đối không chủ quan, lơ là, mất cảnh giác với dịch COVID-19
- Rà soát đối tượng, triển khai tiêm bổ sung vắc xin phòng Covid-19 trong tháng 4-2023
- Bộ Y tế chỉ đạo các địa phương tăng cường phòng, chống dịch Covid-19
- Lo đủ thuốc chữa bệnh cho dân
- Giúp bệnh nhân vơi bớt khó khăn
- Đảm bảo cung ứng đủ thuốc và vật tư y tế
- Những điều nên biết về bệnh Parkinson
- Tỷ lệ tiêm vắc xin thấp, Việt Nam vào nhóm nguy cơ cao xâm nhập bại liệt hoang dại
- Sự nguy hiểm của vi rút Marburg
- Ăn nhiều thịt đỏ gây hại thận
- Phòng, chống bệnh thủy đậu
- Lan tỏa phong trào hiến máu tình nguyện
- Giao mùa, lại phải nhắc chuyện lạm dụng kháng sinh
- Để bớt đi những rủi ro, sự cố đau lòng